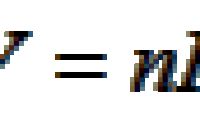
来源百度《精研学习网》
复习笔记
一、热化学
1.几个基本概念
(1)系统与环境
①敞开系统
敞开系统又称开放系统,是指与环境间既有物质交换,又有能量交换的系统。
②封闭系统
③隔离系统
隔离系统又称孤立系统,是指与环境间无物质交换,又无能量交换的系统。
(2)相
相是指系统中具有相同的物理和化学性质的均匀部分。相与相之间存在明确的界面,超过此界面,一定有某些宏观性质发生突变。
①固、液、气三相所具有的特点:
a.气体能够无限混合,故只含气体的系统内只会存在一个气相;
b.液相按照其互溶程度分为一相或两相共存;
c.固体达到分子尺度的均匀混合时只有一个相,即固溶体;否则固体数量与相的数量相同。
②按相的组成来分,系统可分为单相(均相)系统和多相(非均相)系统。
③273.16K和611.73Pa时,冰、水、水蒸气三相共存,被称为H2O的“三相点”。
(3)状态与状态函数
系统的状态是指描述系统的诸如压力p、体积V、温度T、物质的量n和组成等各种宏观性质的综合表现。状态函数是指描述系统状态的物理量。
①状态函数的特点
状态一定,其值一定;状态发生变化,其值也要发生变化;其变化值只取决于系统的始态和终态。而与如何实现这一变化的途径无关。它具有数学上全微分的特征。
②按性质的量值是否与物质的数量有关,状态函数可分为两类:
a.广度性质(又称容量性质)
广度性质的量值与系统中物质的量成正比,具有加和性。
b.强度性质
强度性质的量值与系统中物质的量多寡无关,不具有加和性。
③状态方程
状态函数p、V、T和n之间的定量关系式称为状态方程。
④理想气体状态方程
式中,R为摩尔气体常数,
。
理想气体方程也可以写成
式中,Vm为摩尔体积。
(4)化学计量数和反应进度
①化学计量数
对于一般化学反应
式中,B表示反应中物质的化学式,vB为物质B的化学计量数。
a.化学计量数是量纲为一的量,对反应物取负值,对产物取正值;
b.对于同一个化学反应,化学计量数与化学反应方程式的写法有关;
c.化学计量数只表示当按计量反应式反应时各物质转化的比例数,并不是反应过程中各相应物质实际转化的量。
②反应进度
反应进度ξ定义为
式中,d为微分符号,表示微小变化;nB为物质B的物质的量;vB为B的化学计量数。
a.反应进度只与化学反应方程式有关,而与选择反应系统中何种物质来表示无关;
c.反应进度实际上是以反应方程式整体作为特定组合单元来表示反应进行的程度。在反应进行到任意时刻时,可用任一反应物或产物来表示反应进行的程度,且所得的值总是相等的。
2.热效应及其测量
(1)热效应
化学反应热效应,是指化学反应引起吸收或放出的热量,包括反应热、相变热、溶解热和稀释热等。
(2)热效应的测量
①热化学中,等温、等容过程发生的热效应称为等容热效应;等温、等压过程发生的热效应称为等压热效应。
②当测定某个热化学过程所放出或吸收的热量时,可测定介质的温度改变,再利用下式求得:
式中,q表示一定量反应物在给定条件下的反应热;cs表示吸热介质的比热容;ms表示介质的质量;Cs表示介质的热容,
;ΔT表示介质终态温度T2与始态温度T1之差。
③在实验室和工业上,用弹式热量计精确测定等容条件下固体、液体有机物的燃烧反应热效应qV。
④热化学方程式是表示化学反应与热效应的方程式。
a.写化学方程式时注明反应热的同时,还必须注明物态、温度、压力、组成等条件;
b.若没有特别注明,所说的“反应热”均指等温、等压反应热qp;
c.习惯上,对不注明温度和压力的反应,皆指在T=298.15K,p=100kpa下进行。
二、反应热与焓
1.热力学第一定律
(1)热力学第一定律
①定义
在热力学系统中,能量转化与守恒定律又称热力学第一定律,是指系统的热力学状态发生变化时系统的热力学能与过程的热和功之间的定量关系。
②表达式
封闭系统的热力学第一定律的数学表达式为:ΔU=U2-U1=q+w。
来源百度《精研学习网》




