作者:LLYuan
好久没这么忙了,升职加薪的前兆?(*・ω< )
8月最新招聘见:昆泰医药IQVIA 八月最岗位
敲黑板,扶眼镜,进入正题。
我们都知道,临床试验的最主要研究目的是试验药品的安全性和有效性,然而,我们不知道这句话有一个前提,即试验药品的质量可控性。也就是说,只有在试验用药品的质量可控了,我们才能去讨论药品是否有效,是否安全。
先来看看试验用药品(Investigational Product,IP)的定义吧~
01 IP
老规矩,有请ICH-GCP:
Apharmaceutical form of an active ingredient or placebo being tested or used asa referencein a clinical trial, including a product with a marketing authorization whenused or assembled (formulated or packaged) in a way different from the approvedform, or when used for an unapproved indication, or when used to gain furtherinformation about an approved use.
读不太顺?没关系,有翻译:
在临床试验中用作试验药或对照药的活性药物或安慰剂的药物制剂,包括已批准上市药物应用于新的应用途径或组合(制剂或包装)、应用于新的适应症或用于收集已批准用法的更多信息。
意思就是说,用于试验目的(安全性、有效性)的药物制剂,都可以称为IP。
试验用药品管理(Investigational product Management)则是保证药品质量可控的过程。小编今天就带大家来了解一下,试验项目中如何进行IP管理,IP如何从申办方的仓库送到受试者的手里,CRA又要如何去保证药品的质量可控性。
02 IP Management
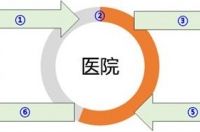
下图就简洁地概括了IP的流经过程:
① 从申办方运输到医院
② 药房库存与内部转运
③ 从医院分发给受试者
④ 受试者使用药物的依从性
⑤ 受试者归还医院
⑥ 医院归还申办方销毁
接着呕心沥血手把手地告诉你,IP在流经这六个步骤时,都是如何去确保IP的质量可控,以及如何完成记录。
03 运输
① 从申办方运输到医院
一般流程是根据试验的需求,系统自动或CRA手动申请IP →申办方运输IP → 医院方接收IP。
以下三件事需要CRA确认:充足的空间,合格的人和适当的文件。
(1)充足的空间
(2)合格的人
医院接受药物的人(如药师,机构老师)都应该是经过培训,有PI授权,并且在接收药物时available,或者有back-up。
(3)适当文件
一般来说,CRA首先需要通过《药品申请表》申请IP;
接收药物时,会出现《IXRS确认表》确认在IXRS中有注册,《药品运输表》记录IP的属性和数量,《药品运输温度表》实时记录IP的温度,《药品接收确认函》表示本次IP的质量和数量经过确认,《药品库存表》记录最终入库的药品。
04 储存
② 药房库存与内部转运
一般来说,IP在药房适合的空间内存放(具体要根据方案要求,有适宜的冰箱和温箱,最好是能上锁),那么CRA需要注意的就是IP的数量以及温度。数量一般会在最后通过库存表等文件记录来核查确认即可。这里CRA最需要操心的就是IP超温。
IP超温常规的处理方法如下:
(1)对于受试者的处理:
如果发现超温时,受试者可能已服用超温IP,那么要做的第一件事就是立即通知受试者停止用药;随后详细报告申办方超温的情况,由申办方进行安全评估,CRA再通知医院方可否继续用药。
(2)对于超温药品的处理:
放置于正确温度环境中,并对其进行隔离(包括物理隔离和IWRS隔离);CRA接到超温的通知之后,进行调查报告,获得申办方反馈后,确定进一步的处理(归还,或是可继续使用);记录PD并报告伦理。
(3)再者,培训相关人员的药品操作流程。
05 分发
③ 从医院分发给受试者
病人随访时,一般是CRC拿着《IWRS发放表》、《处方单》去药房取药给患者,并记录好《药品分发表》以及《药品库存表》。另外,随着IP发给患者,可能还有与服药相关的《用药日记卡》、《用药剂量日历》等。
06 用药
④&⑤ 受试者归还IP时,确认其依从性
(1)受试者在约定时间归还IP时,医院方记录《(受试者)药品回收表》,并通过分发多少和回收多少IP,了解到患者实际上使用多少IP。CRA要确保从药房里分发时与回收时的IP数量一致。
(2)依从性= 实际上使用多少IP/ 应该使用多少IP
07 归还销毁
⑥ 医院归还申办方销毁
按照各个方案和公司SOP的要求对IP进行销毁,可以由院方直接销毁,但更多的是回收到申办方,因为申办方有详细的回收、销毁流程,可以及时记录整个过程,保存相关文件。
这部分一般是CRA在接到回收的任务后,通知申办方的运输部门,提交《药品回收申请表》申请,并打包好准备回收的药品,贴好标签,填好《(医院)药品回收表》,交由申办方销毁,最后存有《药品销毁表》。
08 最后
理论上,IP management负主要管理责任是经过授权和培训的医院方,CRA在此过程只需负责申请药物和回收药物(SDV是事后CRA的工作)。但是,实际工作中,这一块由于直接涉及到受试者安全和数据的完整性等各种原因,CRA还是会花挺多时间在IP mangement上面。而文中的加粗蓝色字体,就是CRA平时需要注意的地方。
不用谢,我感觉胸前的红领巾更鲜艳了。
下一个。




